はじめに
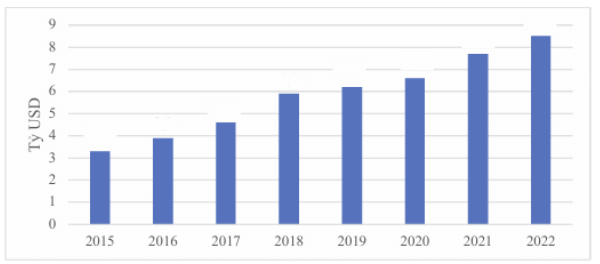
ベトナムの医薬品市場は2024年時点で約74億USD規模とされ、2033年には 140億 USDに達すると予測されている(IMARC Group)。2025〜2033年のCAGRは約7.3%と試算されており、ASEAN でも上位にあり、日本企業にとって中長期の成長機会が大きい市場である。一方、ベトナムでは医薬品の国内生産能力が依然として限定的であり、需要の約 50~70%を輸入に依存してきた。輸入依存度が高いということは、登録手続きや通関規制の変更、審査遅延といった行政運用の影響を国内市場全体が受けやすい構造を意味する。そのため、制度理解だけでなく、照会対応やローカル要件への適応など「実務としてどう成立させるか」が日本企業の成否を決定づける重要な要素となる。
ベトナム薬事の特徴
ベトナムの薬事制度は薬事法(Law No.105/2016/QH13)と関連政令に基づくが、実務では審査官の解釈や運用通知の更新が頻繁に発生する。そのため、制度の変動を前提に事業計画を設計する必要がある。そのため、一度ルールを知るだけでは進まない領域と言える。ここでは薬機法、GMP、GQP、GVPなどの基準にも関連する薬事コンプライアンスが鍵となる。
ベトナムにおける医療の動向
ベトナムの医療費は GDP 比 約4.6%と堅調である。市場の約70%を病院向け(ETC)、30%を薬局向け(OTC)が占めており、売上の相当部分が都市部で形成されているとVietcapは報告している。需要は都市部に集中し、今後も人口構造と所得水準の上昇が市場成長を後押しすると考えられる。
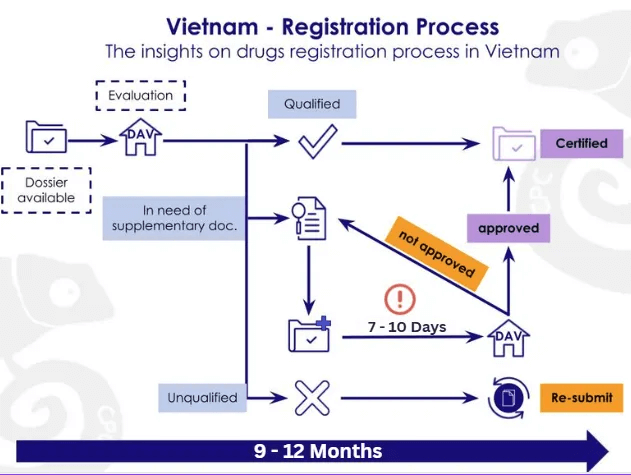
ベトナムにおける医薬品登録は保健省(MOH)傘下の医薬局(DAV)が管轄し、申請はCTD/ACTD構成に準拠するが、特にCTDモジュール1のローカル文書の要求が非常に厳格である。標準審査期間は約12か月だが、薬事法改正案(2024–2025)では新薬・ワクチン・生物製剤(SRA承認品)の審査期間が9か月へ短縮される見込みとされる。市場成長に伴う申請の増加と、投資環境の改善のためベトナム政府が推進する承認の厳格化・行政改革といった要素が絡み合い、医薬局の現場負担が増加している、”成長痛”が生じている状態と考察される。

新薬承認の概況
ベトナムの新薬申請では、一般薬と異なり、Law No.105/2016/QH13に基づき非臨床・臨床データの完全提出、ベトナム規格との薬理・毒性整合性の確認、市販後安全性(PV)体制の事前構築が求められる。ここでCMC(品質パート)、安定性試験、添付文書といった技術文書整合性の管理が重要となる。
また、生物製剤・ワクチン・SRA 承認品は審査期間が短縮される一方、補足資料要求(照会)が発生しやすく、技術文書の整合性が審査の通過率を大きく左右する。そのため、新薬では科学的根拠とローカル要件の両方を理解した薬事体制が不可欠である。新薬の申請は比較的難易度が高い領域である。
外資系企業が苦労する点
ベトナムでは申請書、規格書、添付文書などすべてベトナム語で提出する必要がある。英語→ベトナム語翻訳の齟齬、署名・印章・日付表記の違いは差し戻し要因として頻繁に指摘されている。特にラベル・包装要件は日本やICHと大きく異なるため、わずかな不一致でも再提出が必要になる点が大きなリスクである。ここには翻訳不一致や形式不備といった典型的な薬事課題が含まれる。
翻訳の齟齬は特に日本企業にとって大きな課題である。日本語とベトナム語間での翻訳は、薬事のような専門性の高い分野では翻訳ツールを使用しても未だ十分ではなく、翻訳者を利用する場合も、翻訳者の単なる実力だけでなく過去の経験分野まで拘る必要がある。
ベトナム薬事のプロセスの概要
ベトナムにおける薬事申請プロセスは ①事前準備、②提出、③審査・照会対応、④承認後の運用の4段階で構成される。それぞれの工程で求められる品質が異なり、全工程を俯瞰した管理が重要である。特に申請書作成、ドキュメント管理、照会対応、変更管理(バリエーション申請)といった実務が重要である。
ベトナム薬事の初期段階
ベトナムの薬事承認において申請資料の品質は承認期間を決定づける最大の要因である。CTD/ACTD に基づく書類に加え、ローカル文書(委任状、公証、翻訳、法的文書など)は特に厳格である。安定性試験・品質規格・PIL/ラベル案は薬事専門家によるベトナム語レビューが不可欠であり、初回提出の完成度が低い場合、照会が増えて承認が数ヶ月遅延する。序盤が最も重要である。
ベトナム薬事承認中の照会対応
提出後は DAV が品質・製造工程・GMP・PV・翻訳整合性などを審査し、追加情報が必要な場合は照会が発行される。質問文は抽象的なことが多く、専門的解釈が必要である。回答期限は一般に7〜10営業日と短いため、日本側・現地側・外部コンサルが同時並行でスピーディーに動ける「即応体制」の構築が重要となる。PMS(市販後調査)、GMP評価、当局折衝が重要な要素となる。
ベトナムでの上市後のポイント
MA(医薬品販売承認)を取得した後も、実際に市場へ供給するまでには追加の手続きが必要となる。輸入品の場合、輸入許可の取得、品質検査、価格申請が求められ、ETC製品はさらに 国立および省レベルの入札を経る必要がある(Circular 15/2019/TT-BYT)。一方、OTC 製品は入札を必要としないため上市が容易だが、ラベル表示、広告規制、価格申請など、承認後の運用要件を遵守する必要がある。つまり、「承認=上市完了」ではなく、承認後の流通・価格管理・マーケティング・販路開拓まで含めた総合的な運用設計が事業成功の鍵となる。

ベトナム薬事のリスクや落とし穴
本章ではベトナムの薬事承認における主なリスクを整理する。基本的には、薬事手続き中の小さな不備が大きな遅延を生む時間的な落とし穴が多く、事業計画の後ろ倒しや売上目標の修正が生じてしまうリスクがある。
薬事申請書類の差し戻し
印章位置、書式、翻訳精度などの形式不備は、医薬品登録で最も多い差し戻し要因とされている。実際、医薬局は、登録申請に関する各種通知およびCircular 32/2018/TT-BYTにおいて、書式不備・署名欠落・翻訳不一致を「補正要求の主要理由」と明記している。そのため、日本側と現地側による2段階チェック体制を構築することが、差し戻し削減とリードタイム短縮に直結する。
申請書類の翻訳:薬事承認担当者に刺さる翻訳・書き方がある
日→英→越の多段階翻訳は技術的ニュアンスを損なう。特に品質試験の条件や安定性データは意味解釈のズレが致命的である。技術者同士を直接接続し、翻訳依存を減らす運用設計が望ましい。
薬事承認のパートナー選定
外資企業はLaw No.105/2016/QH13 により、流通・販売を直接行えないため、ディストリビューターやローカル申請代理人の品質管理がリスク要因となる。過去には PMS 違反により販売停止が発生した事例もあり、パートナー選定は薬事リスク管理そのものである。
ベトナムにおける薬事実務の複雑さとONE-VALUEの支援力
ベトナムでの新薬申請・販売フローは、ローカル要件の複雑さ、行政との照会対応、翻訳整合性、申請代理人の品質差などにより、海外企業が最初に直面する大きなハードルとなる。制度を理解していても、実務のどこで詰まりやすいか、現地で何が求められるか、誰に相談すべきかが分からず、時間とコストを失いやすい領域である。
ONE-VALUEは、ベトナム現地に約80名のコンサルタントを配置し、政府機関・医療機関・企業ネットワークを活用して、薬事申請に必要な実務情報・専門家・パートナーへ企業が最短距離でアクセスできる環境を提供する。行政要求の把握、資料整合性の実務助言、信頼できる申請代理人・ディストリビューターの探索支援、上市後の流通・営業面の情報など、薬事の周辺で起こる“最も現実的な課題”を補完し、企業がベトナム薬事を 「迷わず・確実に・効率的に」進められる状態 をつくることがONE-VALUEの強みである。

ベトナムにおける薬事の成否は、制度理解ではなく“伴走者を持てるか”で決まる
ベトナム薬事は制度の複雑さだけでなく、実務運用の細部で思わぬ障壁が生まれる領域であり、日本企業にとっては見えにくいリスクが多いのが実情である。法令を理解していても、そのままではプロセスが前に進まないことが少なくない。
こうした不確実性の中で確実に前進するためには、現地の事情に精通し、必要な専門性とネットワークを持つパートナーの存在が不可欠である。ONE-VALUEは、企業がベトナム薬事を“迷わず・安心して”進められるための伴走支援を提供している。ベトナムでの薬事を検討される企業は、ぜひお気軽にご相談いただきたい。
【関連記事】ベトナムの医薬品に関連する分野ついては、こちらの記事も合わせてご覧ください。
ベトナム市場調査レポート一覧はこちらからもご覧頂けます。

ベトナム市場の情報収集を支援します
ベトナム市場での情報収集にお困りの方は多くいらっしゃるのではないでしょうか。
VietBizは日本企業の海外事業・ベトナム事業担当者向けに市場調査、現地パートナー探索、ビジネスマッチング、販路開拓、M&A・合弁支援サービスを提供しています。
ベトナム特化の経営コンサルティング会社、ONE-VALUE株式会社はベトナム事業に関するご相談を随時無料でこちらから受け付けております。







